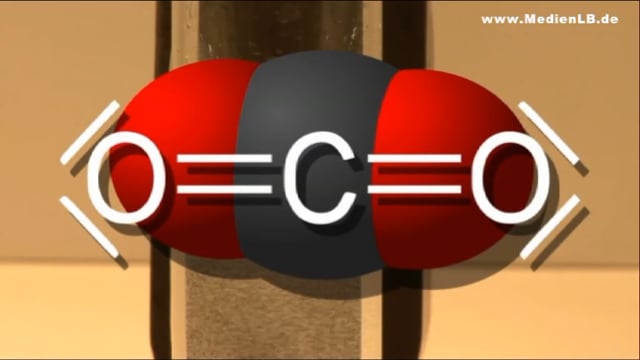
Unterrichtsmaterialien Chemie: Kohlenstoffdioxid
17 MaterialienIn über 17 Dokumenten und Arbeitsblättern für das Fach Chemie: Kohlenstoffdioxid findest du schnell die passenden Inhalte für deine nächste Stunde. Jetzt kostenlos testen und mehr Materialien nach der Anmeldung entdecken!
Auswählen
Auswählen
Auswählen
Auswählen
17 Materialien
Einheit
Die Ozean-Kohlendioxid-RückkopplungM1 Die Ozeane im Zeichen des Klimawandels; M2 Der Einfluss der Temperatur auf die Löslichkeit von Kohlenstoffdioxid; M3a Der Einfluss des Drucks auf die Löslichkeit von Kohlenstoffdioxid; M3b Der Einfluss des Salzgehaltes auf die Löslichkeit von Kohlenstoffdioxid; M4a Der ozeanische Kohlenstoffkreislauf – die physikalische Kohlenstoffpumpe; M4b Der ozeanische Kohlenstoffkreislauf – die biologische Kohlenstoffpumpe; M5 Die Versauerung der Ozeane
Testen kostet nichts
Probiere meinUnterricht 14 Tage lang aus. Kündigst du während deiner Probezeit, entstehen für dich keine Kosten. 🚀
Einheit
„Powerstoff Sauerstoff“ - Sauerstoffhaltige Trendgetränke als authentischer Lernanlass im ChemieunterrichtAus didaktischer Sicht hat das Lösen und Austreiben von Sauerstoff hohen exemplarischen Charakter für die Löslichkeit eines Gases überhaupt. Dies gilt umso mehr als zwischen Sauerstoff und Wasser (im Unterschied zur Reaktion von Kohlenstoffdioxid und Wasser) keine Folgereaktion in Betracht kommt. Die SuS gewinnen Erkenntnisse über Sauerstoff, indem sie selbstständig Versuche durchführen. Didaktische Erläuterungen unterstützen die Lehrkraft bei der Planung, Durchführung und Reflexion des Unterrichts.
video
C, CO2 & Co. Im AlltagAlle organischen Stoffe enthalten Kohlenstoff. Im Erdinneren lagert Kohle. Diese entstand vor ca. 300 Millionen Jahren aus Pflanzen in einem Erdzeitalter, das auch als Karbon bezeichnet wird. Kohlenstoff bildet bei der Verbrennung organischer Stoffe das Gas Kohlenstoffdioxid. Im Wasser gelöst ist es die sogenannte Kohlensäure, Kohlenstoffdioxid ist ein unbrennbares, farb- und geruchloses Gas, das sich gut in Wasser löst. Mit verschiedenen Metalloxiden oder -hydroxiden bildet es zwei Arten von Salzen: die Carbonate und die Hydrogencarbonate. Es ist in Naturprodukten wie z. B. Kreide und Eierschalen als Calciumcarbonat enthalten. Spezielle Formen, Modifikationen genannt, des Kohlenstoffs sind Graphit und auch der besonders wertvolle Diamant. Der Film zeigt die Vielfältigkeit des Kohlenstoffs, Kohlenstoffdioxids und Carbonaten im Alltag sowie Experimente. Zusatzmaterial: Arbeitsmaterialien; Folien; Testaufgaben; interaktive Arbeitsblätter.
video
C, CO2 and other Compounds in Everyday LifeAlle organischen Stoffe enthalten Kohlenstoff. Im Erdinneren lagert Kohle. Diese entstand vor ca. 300 Millionen Jahren aus Pflanzen in einem Erdzeitalter, das auch als Karbon bezeichnet wird. Kohlenstoff bildet bei der Verbrennung organischer Stoffe das Gas Kohlenstoffdioxid. Im Wasser gelöst ist es die sogenannte Kohlensäure, Kohlenstoffdioxid ist ein unbrennbares, farb- und geruchloses Gas, das sich gut in Wasser löst. Mit verschiedenen Metalloxiden oder -hydroxiden bildet es zwei Arten von Salzen: die Carbonate und die Hydrogencarbonate. Es ist in Naturprodukten wie z. B. Kreide und Eierschalen als Calciumcarbonat enthalten. Spezielle Formen, Modifikationen genannt, des Kohlenstoffs sind Graphit und auch der besonders wertvolle Diamant. Der Film zeigt die Vielfältigkeit des Kohlenstoffs, Kohlenstoffdioxids und Carbonaten im Alltag sowie Experimente. Zusatzmaterial: Arbeitsmaterialien; Folien; Testaufgaben; interaktive Arbeitsblätter.
Verwandte Themen
Einheit
Globale ErwärmungDas Kohlenstoffdioxid ist der Hauptgrund für die globale Erwärmung. Es entsteht in erster Linie durch die Verfeuerung der fossilen Brennstoffe (Kohle, Erdöl und Erdgas) zur Energiegewinnung. Energie ist der Antrieb für die Wirtschaft. Deswegen ist Wirtschaftswachstum untrennbar mit einem Anstieg der CO2-Emissionen verbunden. Wir müssen es in den kommenden Jahren schaffen, diesen Teufelskreis zu durchbrechen. Sonst drohen unkalkulierbare Risiken für das Erdsystem.
Einheit
Kohlenstoffdioxid und MeerwasserIm Unterricht wird zunächst Kalkwasser als Nachweisreagenz für Kohlenstoffdioxid benutzt. Bei der hier dargelegten Thematik geht es schwerpunktmäßig um die Umwandlung des Calciumcarbonats mit Hilfe von Wasser und Kohlenstoffdioxid in lösliches Calciumhydrogencarbonat. Diese Reaktionen sollten dem Kompetenzbereich „Bewertung“ zugeordnet werden.
video
Der natürliche KalkkreislaufIn der Luft sind kleine Mengen Kohlenstoffdioxid. Der Film erklärt, wie dieser Stoff durch Regen in Flüsse gelangt und sich dann zu Kohlensäure verbindet. Fließt dieses Wasser über Kalkstein, verbindet sich der Kalk damit und sorgt für hartes Wasser. Er bildet Ablagerungen oder erreicht das Meer.
Testen kostet nichts
Probiere meinUnterricht 14 Tage lang aus. Kündigst du während deiner
Probezeit, entstehen für dich keine Kosten. 🚀
Probezeit, entstehen für dich keine Kosten. 🚀